الصيغة الكيميائية للماء هي وكذلك خصائص الماء هي، كما سنقوم بذكر قطبية جزيء الماء، وكذلك سنوضح شكل جزيء الماء H2O، وكل هذا من خلال مقالنا هذا تابعوا معنا.
محتويات المقال
الصيغة الكيميائية للماء هي
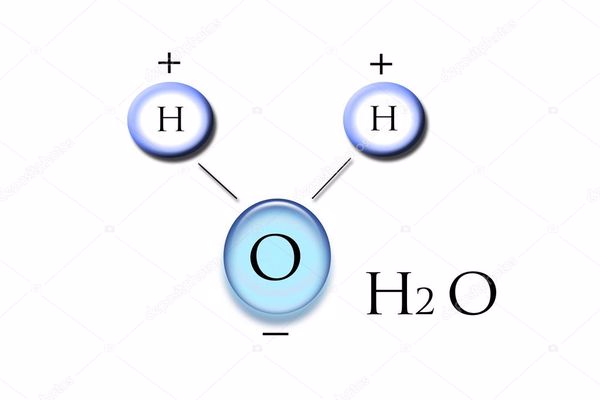
الصيغة الكيميائية للماء هي H 2 O. يتكون جزيء واحد من الماء من ذرة أكسجين واحدة مرتبطة بشكل تساهمي إلى ذرتين هيدروجين.
هناك ثلاثة نظائر للهيدروجين. تفترض الصيغة المعتادة للماء أن ذرات الهيدروجين تتكون من بروتونات النظير (بروتون واحد، لا نيوترونات). الماء الثقيل ممكن أيضا، حيث تتكون واحدة أو أكثر من ذرات الهيدروجين من الديوتريوم (الرمز D) أو التريتيوم (الرمز T).
وتشمل الأشكال الأخرى للصيغة الكيميائية للمياه: D 2 O و DHO و T 2 O و THO. من الممكن نظريًا تكوين TDO، على الرغم من أن مثل هذا الجزيء نادر جدًا.
على الرغم من أن معظم الناس يفترضون أن الماء هو H 2، إلا أن المياه النقية فقط تفتقر إلى العناصر والأيونات الأخرى. تحتوي مياه الشرب عادة على الكلور والسيليكات والمغنيسيوم والكالسيوم والألمنيوم والصوديوم وكميات ضئيلة من الأيونات والجزيئات الأخرى.
أيضا، الماء يذوب نفسه، وتشكيل أيوناته، H + و OH -. تحتوي عينة من الماء على جزيء ماء سليم مع كاتيونات هيدروجين وأنيونات هيدروكسيد.
خصائص الماء هي
1- القطبية:
يتمتّع الماء بقطبية (بالإنجليزية: Polarity) عالية، نتيجةً للروابط التساهمية التي تربط ما بين ذرتي الهيدروجين مع ذرة الأكسجين، حيث تتمتّع ذرة الأكسجين بكهرسلبية عالية تسمح لها بجذب الإلكترونات المشترِكة معها في تلك الروابط التساهمية، فتتكوّن القطبية على إثر تجمّع الإلكترونات لوقتٍ أطول حول نواة ذرة الأكسجين المشحونة بشحنة جزئية سالبة ووقتاً أقل حول نواتي ذرات الهيدروجين المشحونة بشحنة جزئية موجبة في جزيء الماء؛ وذلك لاحتوائهما على بروتونات إضافية غير متعادلة.
يُشير ما سبق إلى أنّ الأكسجين قادر على جذب إلكترونات بعض المواد الأخرى نحوه في جزيء الماء أكثر من الهيدروجين، ويُطلق على المواد التي تنجذب للماء وتتفاعل معه بالمواد المحبّة للماء (بالإنجليزية: Hydrophilic)؛ كالسكّريات، أمّا المواد التي لا تتفاعل مع الماء فتُعرف بالمواد الكارهة أو الطاردة للماء (بالإنجليزية: Hydrophobic)؛ كالزيوت والدهون.
2- الإذابة:
تحدث غالبية التفاعلات الكيميائية المهمّة في الحياة داخل وسط مائيّ في خلايا الكائنات الحية، فالتركيبة الكيميائية والخصائص الفيزيائية للماء جعلت منه مُذيباً رائعاً للعديد من المواد، لذا يُطلق عليه اسم المُذيب الشامل (بالإنجليزية: Universal Solvent)؛ نظراً لقدرة الماء العالية على إذابة المواد أكثر من أيّ سائلٍ آخر، بالإضافة إلى قطبيته العالية وقدرته على تكوين الروابط الهيدروجينية، لذلك يُعدّ الماء عاملاً أساسياً لحدوث التفاعلات الكيميائية داخل أجسام الكائنات الحيّة.
تسمح قطبية الماء العالية بجذب العديد من جزيئات المواد المختلفة بدرجات متفاوتة فتتأثّر قدرته على الإذابة نتيجة لذلك، فمثلاً ينجذب الماء بشدّة إلى العديد من الجزيئات من ضمنها كلوريد الصوديوم (NaCl) الذي يُعرف بملح الطعام؛ وذلك من خلال تفكيك الروابط بين جزيئات الصوديوم والكلوريد عن بعضهما البعض وتكسيرها، وبالتالي إذابتهما تماماً داخله.
3- السعة الحرارية:
يتمتّع الماء بسعةٍ حرارية (بالإنجليزية: Heat Capacity) كبيرة جداً، أيّ أنّ قدرته على تخزين الحرارة كبيرة، وهذا الأمر كفيل بتنظيم العديد من الظواهر التي تحدث في الطبيعة، وبمعنى آخر يتطلّب جعل الماء ساخناً قدراً كبيراً من الطاقة والحرارة، حيث يحتاج 1 كغم من الماء امتصاص حوالي 4184 جول -أيّ ما يُعادل 1 سعر حراري- من الطاقة لزيادة درجة حرارته درجة مئوية واحدة فقط، بينما يحتاج 1 كغم من النحاس إلى 385 جول فقط لرفع درجة حرارته بمقدار درجة مئوية واحدة، وتُساعد الأسماك على تنظيم درجات حرارتها النسبية في الماء نهاراً وليلاً؛ نظراً لثبوت درجة حرارة الماء في البرك خلال اليوم.
4- حرارة التبخر:
يُعرّف التبخر (بالإنجليزية: Evaporation) بأنّه العملية التي تتحوّل عندها المادة من الحالة السائلة إلى الحالة الغازية، وكما يتطلّب الأمر الكثير من الطاقة لرفع درجة حرارة الماء السائل، فإنّ الماء يحتاج أيضاً إلى قدرٍ كبير جداً من الطاقة لتغيير حالته السائلة إلى الغازية عند ثبوت درجة الحرارة، ويتبخّر الماء نتيجة تكسّر الروابط الهيدروجينية بين جزيئاته؛ نتيجةً لزيادة درجة الحرارة والطاقة، فيُؤدّي ذلك إلى زيادة حركة جزيئات الماء واهتزازها بشكلٍ كبير جداً، فتتحوّل جزيئات الماء السائلة إلى جزيئاتٍ من بخار الماء تتطاير وتهرب إلى الغلاف الجوي.
تحتاج جزيئات الماء إلى درجة حرارة مقدارها 100 درجة مئوية لكي تتبخر، وهي نقطة غليان الماء التي تكتسب فيها الجزيئات طاقة حركية عالية تُؤدي إلى تبخّرها، أمّا درجة حرارة السطح الذي تحدث عنده عملية التبخر فتُصبح أكثر برودةً نتيجة لذلك، ومثال ذلك تبخر العرق من جسم الإنسان عند درجات الحرارة العالية للحفاظ على ثبات درجة حرارة الجسم.
5- التماسك والتلاصق:
ترتبط جُزيئات الماء مع بعضها البعض بشكلٍ جيد؛ نتيجة امتلاك الماء خاصية تُعرف بخاصية التماسك (بالإنجليزية: Cohesion)، وتُشير هذه الخاصية إلى قدرة جُزيئات المادة الواحدة على الانجذاب لبعضها البعض، حيث تحدث نتيجةً للقطبية العالية لجزيئات الماء التي تسمح لها بتكوين الروابط الهيدروجينية.
يُمكن تفسير خاصية التماسك من خلال تجربة بملء كأس من الماء إلى أقصى حدٍّ ممكن قبل انسكابه، ومُلاحظة تجمّع سطح الماء على شكل قبة فوق حافة الكأس، حيث يُفسّر شكل القبة الناتج على السطح شدّة تماسك جزيئات الماء مع بعضها البعض، ومن الجدير بالذكر أنّ قوى التماسك مسؤولة عن ظاهرة التوتر السطحي (بالإنجليزية: Surface Tension) التي تحدث للماء، وهي ظاهرة تُوضّح ميل سطح السائل إلى مقاومة أيّ إجهاد أو توتّر يتعرّض له.
يحدث نوع آخر من التجاذب بين جُزيئات الماء وجُزيئات المواد الأخرى خاصةً إن كانت تحمل شحنات موجبة أو سالبة تحت ظروف معينة؛ وذلك لأنّ الماء يتميّز بخاصية أخرى تُعرف باسم خاصية التلاصق (بالإنجليزية: Adhesion)، والتي تحدث بين نوعين مُختلفين من الجزيئات، كما تُعدّ هذه الخاصية مسؤولة عمّا يُعرف بالخاصية الشعرية (بالإنجليزية: Capillary Action) التي تُمكّن الماء من الارتفاع إلى أعلى، أيّ عكس الجاذبية الأرضية.
يُلاحظ الترابط بين قوى التماسك والتلاصق في العديد من الظواهر الموجودة في الطبيعة، ومثال ذلك آلية حصول النبات على الغذاء والمعادن من خلال سحب الماء من جذور النباتات إلى الأوراق، بالإضافة إلى اعتماد بعض الحشرات على خاصية التوتر السطحي للسير على الماء واتخاذه وسطاً للتزاوج.
6- الكثافة:
تتجمّع جزيئات الماء المتجمّد على شكل بلوراتٍ متباعدة عن بعضها البعض على نحوٍ أكثر من تباعد جزيئاته وهو في الحالة السائلة، أيّ أنّ حجمه يزداد نتيجة التجمّد، وبالتالي فإنّ كثافة الماء عندما يتجمّد تكون أقل من كثافته وهو في الحالة السائلة، ولذلك يطفو على السطح، وهذا الأمر ضروري للكثير من الحيوانات التي تعيش على الجليد، حيث يحمي مواطنها من الغرق.
تُشكّل الطبقة الجليدية في أعلى البرك طبقةً عازلةً بين الهواء البارد والماء الذي يقع أسفلها فتُحافظ على درجة حرارته، وبالتالي تُساعد الأحياء البحرية على البقاء على قيد الحياة وتحميها خلال فصل الشتاء، ومن الجدير بالذكر أنّ أعلى كثافة للماء تكون عندما تبلغ درجة الحرارة 4 درجات مئوية، وبعد ذلك يُصبح الماء أقل كثافةً مرّةً أخرى، أيّ أنّ كثافة الماء تقل مع التبريد المُستمر.
قطبية جزيء الماء
تتولّد للماء شحنات كهربائية، لأنّ ذرات الأكسجين أكثر كهروسلبية من ذرات الهيدروجين، وبالتالي فإنّ ذرات الأكسجين تميل لجذب الإلكترونات المشتركة مع الهيدروجين، من خلال روابطها التساهميّة، لكنّ الإلكترونات تقضي وقتًا أطول حول مركز ذرّة الأكسجين مقارنةً بما تقضيه حول ذرة الهيدروجين، بسبب اختلاف أحجام الذرات لذلك تنشأ الروابط التساهميّة القطبية.
ونظرًا لأنّ جزيء الماء غير خطي، فإنّه ينشأ اختلاف في الشحنة بين جانبيّ جزيء الماء، فالجانب الذي يحمل الأكسجين ذا شحنة سالبة جزئية، والجانب الذي يحمل الهيدروجين يكون ذا شحنة موجبة جزئية.
شكل جزيء الماء H2O
يكون شكل جزيء الماء منحنياً ومكوّناً من ذرة أكسجين وذرتي هيدروجين، وتبلغ زاوية الانحناء بين مكونات جزيء الماء (H-O-H) نحو 105 درجة، حيث ينشأ الشكل الفراغي لجزيء الماء نتيجة الرابطة التساهمية التي تحدث بسبب الكهرسلبية العالية لذرة الأكسجين، والتي تجذب الإلكترونات بما يفوق جذب الهيدروجين لها، وبالتالي تكتسب ذرة الأكسجين شحنة جزئية سالبة في حين تكتسب ذرتي الهيدروجين شحنة جزئية موجبة.
تنتج قطبية جزيء الماء بسبب الشكل المنحني للجزيء، ولاختلاف شحنات العناصر الموجودة في الجزيء، إذ تتجمّع الإشارة السالبة للأكسجين على جانب الجزيء في حين تتجمّع الإشارة الموجبة لذرتي الهيدروجين على الجانب الآخر، إذ إنّ كلمة قطبي تعني أنّ الشحنات الكهربائية غير موزّعةً بالتساوي.