تأثير السموم على الجهاز العصبي نتحدث عنها من خلال مقالنا هذا كما نذكر لكم مجموعة متنوعة أخرى من الفقرات مثل أعراض تسمم الجهاز العصبي المركزي و نبذة عن السموم المعوية وعوامل السمية العصبية.
محتويات المقال
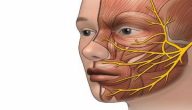
تأثير السموم على الجهاز العصبي
يلعب جهازك العصبيّ المركزيّ دورًا دقيقًا في جسدك، كذلك فإنّه شديد الحساسية للسموم الخارجية. وتقسم الأنواع الرئيسيّة للتغيرات الناجمة عن السموم إلى ثلاث فئات:
1-داخلية:
تسبب تراجع الأنشطة الدماغيّة كالتعلّم، وضعف الذاكرة، كما عند التعرّض لمستويات منخفضة من الزئبق غير العضويّ، وأحادي أكسيد الكربون.
2-حركيّة:
يصيب الضرر الخلايا العصبيّة الحركية، علي سبيل المثال يسبّب الهيدرازيد المُستخدم لعلاج السلّ في ضعف العضلات وشللها.
3-حسيّة:
تصيب الخلايا العصبية الحسيّة، والمستقبلات الحسيّة، فتؤثّر على حواس الجسم،. من الأمثلة، قد يُسبّب التعرّض للمعادن الثقيلة كالرّصاص والزئبق فُقدان السمع والرؤية.
آليات حدوث ضرر المواد السامّة للجهاز العصبيّ:
قد يكون مباشرًا ويصيب الخلايا العصبية والخلايا الدبقية، فتُقلل بعض المواد من قدرتها على تخليق البروتين اللازم لأدائها الوظيفيّ، أو تتدخّل في عملية التمثيل الغذائي الخلويّ، وتسبّب نقص إمدادات الأكسجين، أو عدم قدرتها على استخدامه، فتموت الخلايا والسبب هنا يعود لانخفاض مقدرة الهيموغلوبين على نقل الأكسجين، كما يحدث عند ارتباط أوّل أكسيد الكربون ونتريت الصوديوم بالهيموجلوبين، ممّا يمنع الدم من نقل الأكسجين إلى الأنسجة.
أعراض تسمم الجهاز العصبي المركزي
فيما يلي العلامات والأعراض العامة الأكثر شيوعًا لتسمم الجهاز العصبي المركزي مع ذلك، كل فرد قد يختبر الأعراض بشكل مختلف. قد تشمل الأعراض:
1-مشكلات الإبصار، مثل الرؤية المزدوجة أو العمى
2-مشاكل السمع أو الصمم
3-حركة غير طبيعية، مثل الرعاش أو صعوبة المشي
4-فقدان الاتزان
5-فقدان البصر أو ازدواج الرؤية.
6-فقدان الذاكرة.
7-ضعف القدرة العقلية.
8-ظهور صداع مستمر أو مفاجئ.
9-صداع يتغير أو يختلف.
10-فقدان الإحساس أو الوخز.
11-ضعف أو فقدان قوة العضلات.
12-عدم التنسيق.
13-تصلب العضلات.
14-الهزات والنوبات.
15-الخدر أو فقدان الإحساس باللمس
16-مشكلات في التخاطب، كعدم القدرة على الكلام أو تلعثم النطق
17-صعوبة البلع أو الشعور “بتورم في الحلق”
18-نوبات الارتعاش وفقدان الوعي الواضح (نوبات غير صرعية)
19-نوبة من عدم الاستجابة
السموم المعوية
-السموم المعوية للمكورات العنقودية هي مجموعة بروتينات بسيطة قابلة للذوبان في الماء. تنتج المكورات العنقودية المعوية الذيفان المعوي سمومًا معوية في الأطعمة التي تكون فعالة على الجهاز الهضمي وتسبب “التسمم الغذائي بالمكورات العنقودية”. المكورات العنقودية الذهبية هي أهم أنواع المكورات العنقودية المنتجة للسموم المعوية.
-المكورات العنقودية من مسببات الأمراض التي تؤثر سلبًا على صحة الإنسان. عادة ما تستقر على الجلد والأغشية المخاطية للفم والأنف ، وعلى جلد اليدين والقدمين ، وتحت الشعر مثل الشعر والشارب ، وفي قناة الأذن. تصبح المكورات العنقودية الذهبية خطرة إذا كان هناك انخفاض في مقاومة الجسم ، أو زيادة في عدد البكتيريا في الجسم ، أو تكوين سم معوي.
-لا يتم تدمير السموم المعوية للمكورات العنقودية في درجات حرارة البسترة ، والتي تكون قابلة للحرارة. يحدث التهاب الضرع بشكل خاص في أبقار الألبان بسبب بكتريا المكورة العنقودية البرتقالية. يحدث “التسمم الغذائي بالمكورات العنقودية” عندما يحتوي 100 جرام من الطعام على 100 نانوغرام على الأقل من السم المعوي.
-يمكن العثور على المكورات العنقودية الذهبية في أنف أو أيدي الأشخاص الذين يعملون في صناعة الأغذية ، على وجه الخصوص. يتم البحث عن Stephylococci في المنتجات الغذائية ، وإذا تم اكتشافها ، فيمكننا الحصول على فكرة عن الإنتاج والتشغيل والنظافة الشخصية وبيئة العمل.
عوامل السمية العصبية
1-جذور الأكسجين
يتم تشكيل جذور الأكسجين في الدماغ من خلال مسار حمض النيتريك (NOS) حيث يحدث هذا التفاعل كاستجابة للزيادة في تركيز كربونات الكالسيوم (+Ca 2) داخل خلية الدماغ. وينتج هذا التفاعل بين كربونات الكالسيوم (+Ca 2) و حمض النيتريك NOS في تكوين عامل التتراهيدروبيوبترين (BH4) الذي ينتقل بعد ذلك من غشاء البلازما إلى السيتوبلازم. كخطوة أخيرة يعتبر حمض النيتريك NOS الغير مفسفر (NO) الذي يتراكم في الدماغ وزيادة الإجهاد التأكسدي . هناك العديد من أنواع الأكسجين التفاعلية (ROS) بما في ذلك الاكسيد الفائق وبيروكسيد الهيدروجين والهيدروكسال وكلها تؤدي إلى السمية العصبية. وبطبيعة الحال يستخدم الجسم آلية دفاعية للحد من الآثار المميتة للأنواع التفاعلية عن طريق استخدام بعض الإنزيمات لتحليل أنواع الأكسجين التفاعلية (ROS) إلى جزيئات صغيرة حميدة من الأكسجين والماء البسيط. ومع ذلك فإن هذا الانهيار من أنواع الأكسجين التفاعلية (ROS) ليس فعال تماما. تترك بعض المخلفات التفاعلية في الدماغ لتتراكم مما يسهم في السمية العصبية وموت الخلايا. ويكون الدماغ أكثر عرضة للإجهاد التأكسدي من الأعضاء الأخرى بسبب قدرته التأكسدية المنخفضة. نظرًا لأن الخلايا العصبية تتميز بأنها خلايا مفصلية أي أنها تعيش مع تلف متراكم على مر السنين حيث أن تراكم أنواع الأكسجين التفاعلية (ROS) مميت. وبالتالي فإن زيادة مستويات خلايا العمر الأكسجينية التفاعلية (ROS) يؤدي إلى تسارع العمليات العصبية وفي نهاية المطاف إلى تطور مرض الزهايمر (AD).
2-حمض الجلوتاميك
حمض الجلوتاميك هي مادة كيميائية موجودة في الدماغ تشكل تهديدًا سامًا للخلايا العصبية عند وجودها بتركيزات عالية. ويعتبر توازن التركيز هذا دقيق للغاية وعادة ما يتم العثور عليه في كميات تركيز المادة خارج الخلية. عندما يحدث اضطراب يحدث تراكم حمض الجلوتاميك نتيجة لطفرة في ناقلات الجلوتاميك والتي تعمل كمضخات لتصريف الجلوتاميك من الدماغ. هذا يجعل تركيز الجلوتاميك في الدم أكثر عدة مرات من الدماغ وبدوره يجب على الجسم أن يعمل للحفاظ على التوازن بين تركيزين اثنين عن طريق ضخ الجلوتاميك من مجرى الدم وإلى خلايا عصبية من الدماغ. في حالة حدوث طفرة فإنه لن يتمكن ناقلو الجلوتاميك من ضخه في الخلايا وبالتالي يتراكم تركيز أعلى في مستقبلات الجلوتاميك. وهذا يفتح القنوات الأيونية مما يسمح للكالسيوم بدخول الخلية مما يسبب التسمم. ينتج حمض الجلوتاميك في موت الخلايا عن طريق تشغيل مستقبلات حمض الاسبراتيك (N-methyl-D-aspartic NMDA) (وهو حمض اميني نشط) هذه المستقبلات تسبب زيادة في إفراز أيونات الكالسيوم (+Ca2) في الخلايا. ونتيجة لذلك يزيد التركيز المتزايد للكالسيوم مباشرة من الإجهاد على الميتوكوندريا (وهي عضية مزدوجة الغشاء موجودة في معظم الكائنات حقيقية النواة) مما يؤدي إلى فسفرة تأكسدية مفرطة وإنتاج أنواع الأكسجين التفاعلية (ROS) عن طريق تنشيط حمض النتريك مما يؤدي في النهاية إلى موت الخلايا. كما ان خلايا بيتا اميلويد تقوم بمساعدة هذا المسار لتسبب السمية العصبية عن طريق تعزيز ضعف الخلايا العصبية للجلوتاميك.
3-بيتا اميلويد Aβ
تعتبر المادة المسماة بيتا اميلويد من مسببات السمية العصبية وموت الخلايا في الدماغ عند وجودهها في تركيزات عالية حيث تحدث كطفرة عندما يتم قطع سلاسل البروتين في المواقع الخاطئة مما يؤدي إلى سلاسل ذات أطوال مختلفة غير قابلة للاستخدام. وهكذا يتم تركها في الدماغ حتى يتم تكسيرها ولكن إذا تراكم ما يكفي فإنها تشكل لويحات سامة للخلايا العصبية. تستخدم بيتا اميلويد Aβ عدة طرق في الجهاز العصبي المركزي لتسبب موت الخلايا. ومن الأمثلة على ذلك مستقبلات الأستيل كولين النيكوتينية (nAchRs)، وهي عبارة عن مستقبل موجود بشكل شائع على طول أسطح الخلايا التي تستجيب لتحفيز النيكوتين مما يؤدي إلى تشغيلها أو إيقاف تشغيلها. تقوم بيتا املويد مع خلايا بروتين الطاقة MAP (بروتين كيناز يعمل بنظام ميتوجين) وهي مستقبلات إشارة اخرى تفوم على التلاعب بمستوى النيكوتين في الدماغ لتسبب موت الخلايا حيث تقوم بيتا اميلويد بتنظيم مادة كيمايائية اخرى في الدماغ تدعى (JNK) حيث ان هذه المادة تقوم بإيقاف مسار كيناز خارج الخلية والذي بدوره يعمل عادةً على التحكم بالذاكرة في الدماغ. ونتيجة لذلك تتوقف هذه الذاكرة لصالح المسار ويفقد الدماغ وظيفة الذاكرة الأساسية. يعد فقدان الذاكرة هو أحد أعراض المرض العصبي بما في ذلك مرض الزهايمر. وهناك طريقة اخرى تقوم بيتا اميلويد على موت الخلايا وهو من خلال فسفرة بروتين كيناز AKT حيث يحدث هذا عندما يرتبط عنصر الفوسفات بعدة مواقع على البروتين. تسمح هذا الفسفرة لـ بروتين كيناز AKT بالتفاعل مع البروتين المضاد BAD. وبالتالي فإن الزيادة في بيتا اميلويد Aβ ينتج عنها زيادة في مجمع AKT / BAD، مما يؤدي بدوره إلى إيقاف عمل البروتين المضاد Bcl-2، والذي عادة ما يعمل على إيقاف موت الخلايا مما يتسبب في انهيار العصبون المتسارع وتطور الميالين.