خصائص الماء الكيميائية وكذلك خصائص الماء الفيزيائية، كما سنقوم بذكر حالات الماء، وكذلك سنتحدث عن خصائص الماء هي، وكل هذا من خلال مقالنا هذا تابعوا معنا.
محتويات المقال
خصائص الماء الكيميائية
1- التعادل الحمضي:
يعدّ الماء مادة متعادلة كيميائياً، لأنّ درجة حموضيته وقواعديته هي سبع درجات، وبهذا لا يمكن اعتباره مادة حمضية أو مادة قواعدية.
2- الإذابة:
الماء يُذيب جميع المواد لأنّه مادة مقتطبة تحتوي على أيونات حرّة، فلذلك فإنّ كثيراً من الأملاح والمواد تذوب بالماء، لذا لا يوجد ماء نقي بنسبة 100% لأنّ هناء غازات ووأملاح مُذابة فيه.
3- الثّقل:
يعرف بالماء الثقيل وهو تركيب مكوّن من اتحاد الديوتريوم مع الأكسجين، تتكون قطرة الماء الواحدة من ملايين الجزيئات التي تتكون من ذرات الأكسجين والهيدروجين ويتكوّن الماء النقي من نسبة بسيطة من الديوتريوم وهو ما يُعرف بذرة الهيدروجين التي تزن أكثر من الذرة العادية، فلذلك يُطلق على الماء المؤلف من ذرات الديوتريوم وذرات الأكسجين بالماء الثقيل.
4- القابلية للتوصيل الكهربائي:
الماء موصل جيد للكهرباء بسبب كمية الأملاح المذابة به، فهو وحده يُعدّ موصل كهربائي سيئ.
5- الروابط الكيميائية:
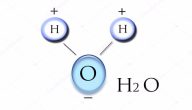
يعدّ الماء ببناء ذا تركيب قوي، فتركيبة الكيميائية تعطيه تلك القوة، فجزيء الماء الواحد مكوّن من ذرتي هيدروجين وذرة أكسجين، فيكون هناك إلكترونين يدوران حول نواتين في كل من ذرتي الهيدروجين، وهناك متسع لإلكتورنين اثنين ولذرة الأكسجين ستة إلكترونات وهناك متسع لاثنين آخرين، فعند اتحاد الذرتين معاً تمتلئ النواقص في ذرتي الهيدروجين وذرة الأكسجين ليتكوّن جزيء ماء ذا قوة وترابط.
6- التماسك والترابط:
الماء من أشدّ السوائل تماسكاً وترابطاً، ويمكن ملاحظة ذلك من خلال وضعه بوعاء وملاحظة انجذاب سطحه للداخل وكأنّ شيئا يجذبه، ولو وضُع عنكبوت فأنّه يسير على سطحه وكأنّه يسير على سطح صلب، وهو ما يُعرف بظاهرة التوتر السطحي للماء، لذا يُرى الماء عندما ينسكب يتشكل على هيئة قطرات، ونتيجة لهذه الخاصية فإنه كلّما يقلّ قطر الأنبوب الذي يوجد فيه الماء فإنّه يصعد إلى الأعلى وكأنّه يتسلق جدرانه وهذا ما يُعرف بالخاصية الأسموزية التي تجعل لماء ينتقل من التربة عبر جذوع الأشجار والأغصان، وكذلك فإنّ هذه الخاصية مسؤولة عن حركة الدّم داخل الأوعية الدموية في جسم الإنسان.
7- استقرار الحرارة:
يغلي الماء على درجة حرارة مئة، وهذا خاص به من دون المركبات الهيدروجنية المشابه له في التركيب، لأنّها تغلي على درجة حرارة سبعون، فلو كان الماء مثلها لكان موجوداً على سطح الأرض في درجات الحرارة الاعتيادية بخاراً، ومن مظاهر الاستقرار الحراري للماء أنّه إذا وضع في وعاء معدني كالحديد مثلاً ووضع على النار فإنّه يحتاج لوقت أطول منه إذا وضع ذلك الوعاء فارغاً، لارتفاع معامل حرارة الماء النوعية، وبينما يُلاحظ ارتفاع درجة رمال السواحل بجانب البحار والمحيطات وماءها بارد، ونجده بارداً في الليل والماء دافئ.
8- منحنى الكثافة الفريد:
من الخصائص الفريدة والتي تعدّ شذوذاً للماء أنّه إذا تمّ تبريده ينكمش حجمه وتزداد كثافته، وتتوقف هذه الخاصية عند درجة أربع مئوية، وإذا تمّ تبريده أكثر فإنّ حجمه بدلاً من أنْ ينكمش يأخذ بالتمدد.
خصائص الماء الفيزيائية
1- درجة الحرارة:
تتراوح درجة حرارة المياه في الجداول والأنهار في جميع أنحاء العالم من صفر إلى 35 درجة مئوية، وتؤثر درجة الحرارة على عدة خصائص فيزيائية مهمة للماء منها: الوزن النوعي، وقابلية الذوبان للغازات المذابة، والقدرة الحرارية، والتوتر السطحي، والملوحة، والكثافة، والموصلية النوعية، واللزوجة، وعند زيادة درجة حرارة المياه تزداد معدلات التفاعل الكيميائي والبيولوجي بشكلٍ عام.
2- المواد الصلبة:
المواد الصلبة هي ما تبقى بعد تبخر الماء وتجفيف المادة المتبقية عند درجة حرارة تتراوح من 103 إلى 105 درجة مئوية، وتصنف المواد الصلبة على أنّها مواد صلبة عالقة ومواد صلبة قابلة للفلترة يتم تصنيفهما على أساس حجم الجسيمات والاحتفاظ بالجوامد المعلقة على فلاتر الألياف الزجاجية القياسية، ومواد صلبة مستقرة وهي عبارة عن الطمي والمواد الصلبة العضوية الثقيلة التي تستقر متأثرة بالجاذبية.
3- العكورة:
تعني عكورة المياه كمية الضوء التي تشتتها المادة في الماء عندما يضيء ضوء من خلال عينة المياه، وكلما ازدادت كثافة الضوء المشتت كانت درجة العكورة أعلى، ومن أهم المواد التي تتسبب في عكورة المياه المركبات العضوية الملونة القابلة للذوبان، والطين، والطحالب، والعوالق والكائنات الحية المجهرية الأخرى، والطمي، والمواد العضوية وغير العضوية المنقوصة.
4- طعم ورائحة الماء:
يرتبط طعم ورائحة الماء الموجودين في عينة محددة برائحة العتبة أو رقم رائحة العتبة، ويتم قياسهما بواسطة مصطلح يطلق عليه شدة الرائحة، وبعد الانتهاء من القياس يتم تخفيف ماء العينة بماء خالٍ من الرائحة بشكل تدريجي، ويُطلق على عدد المرات التي تُخفف العينة بها رقم رائحة العتبة، وكما يعتمد اكتشاف الرائحة في الخليط على الملاحظة البشرية فقط، وينبغي أن لا يكون للماء رائحة؛ أي أن يكون رقم العتبة 1، ومن المهم أن لا يتجاوز 3 نهائياً.
حالات الماء
1- الحالة الصّلبة (بالإنجليزية: solid phase):
يكون الماء فيها على شكل ثلجٍ ذي لونٍ أبيض ناصع، أو على شكل جليد، ويبدأ الماء في التجمد عندما تكون درجة الحرارة صفر مئويّ.
2- الحالة الغازيّة (بالإنجليزية: gaseous phase):
يكون الماء على شكل بخار ماء، ويصبح في هذه الحالة عندما يصل إلى درجة الغليان، أي 100 درجة مئويّة.
3- الحالة السّائلة (بالإنجليزية: liquid phase):
هي الحالة السّائدة للماء، ويكون فيها بلا رائحة أو لون، ويُشكّل الماء السّائل 70% من مساحة الكرة الأرضيّة، ويكون الماء في الحالة السّائلة في درجات الحرارة المحصورة بين درجتي: التّجمد، والتّبخر.
خصائص الماء هي
– الماء ليس له طعم، ولا لون، ولا رائحة.
– القدرة على التفاعل مع المواد الكيميائية المتنوعة.
– الشذوذ، أي الكثافة الكتلية، حيث عند تجمدها يزداد حجمها، وتقل كثافتها.
– الإذابة، حيث يتسم الماء بقدرته على إذابة الكثير من المواد المتنوعة، فهو يعد من المذيبات القطبية.
– قوة التماسك، حيث إن جزيئات الماء متماسكة ومترابطة بقوة عالية، وذلك لاحتوائه على الروابط الهيدروجينية، والروابط الكيميائية، لذلك الماء يأخذ الشكل الكروي عند توتر سطحه.
– موصل سيء للكهرباء.
– التحول من حالة إلى حالة أخرى، أي يتواجد الماء في ثلاث حالات، الحالة الصلبة كالجليد، والحالة الغازية كالبخار، والحالة السائلة كجريان الماء النهري.
– موصلة للحرارة.
– مزيج انفجاري، حيث يصنف الماء بشكل كيميائي بأنه أكسيد للهيدروجين، وهو ينشأ عند احتراق الهيدروجين، أو أي مادة تحتوي عليه بالأكسجين.
– درجة الحموضة، حيث يتميز الماء بأنه من المواد السائلة المتعادلة كيميائياً.
– الملوحة، أي انتقال الماء من وسط قليل الملوحة إلى وسط عالي الملوحة.
– يتسم بأنه عسر ويسر، فعندما يحتوي الماء على نسبة عالية جداً من الأملاح المعدنية كالكالسيوم، والكبريتات، والمغنيسيوم، والبيكربونات يصبح الماء عسراً، وعندما يحتوي الماء على نسبة منخفضة من الأملاح المعدنية يصبح يسراً.
– ناقلة لموجات الصوت.